- История батарейки - гальванического элемента
- Эволюция батарейки - солевой гальванический элемент
- Как работает сухая батарейка (солевой гальванический элемент)
- Что находится внутри щелочной батарейки
- Как работает батарейка
- Как работает батарейка - видео
- Форм-фактор распространенных гальванических элементов
Батарейка (гальванический элемент) — как работает, из чего состоит

Батарейка это прижившееся и не совсем корректное название одиночного гальванического элемента. А уже их соединение в источниках питания для создания нужного напряжения — это батарея. Поэтому не стоит путать эти определения. И если называя гальванический элемент батарейкой, мы поступаем не совсем верно (но смысл понятен), то слово батарея абсолютно никакого отношения не имеет к одиночным химическим источникам электрического тока.
Данный обзор посвящен гальваническому элементу (батарейке) — химическому источнику электрического тока, основанному на взаимодействии двух металлов и (или) их оксидов в электролите, приводящих к возникновению в замкнутой цепи электрического тока. Мы подробно рассмотрим конструктивные особенности элемента, определимся с классификацией и разберемся, как работает батарейка.
История батарейки — гальванического элемента
Свое название гальванические элементы получили по имени итальянского врача и анатома Луиджи Гальвани (1737 — 1798). Проводя опыты с лягушками, Гальвани заметил, что свежепрепарированная лягушачья лапка, подвешенная на медном крючке к железному стержню, сокращается, когда к ней прикасались железом. Наблюдения были истолкованы им как проявление «животного электричества».
Объясняя это явление позже итальянский физик Александро Вольта установил, что причиной сокращения мышц служит не «животное электричество», а наличие цепи из разных проводников в жидкости. Сама лягушачья лапка играла роль чувствительного прибора.
Александро Вольта создал первый источник тока («Вольтов столб»), который можно было использовать на практике. Этот источник состоял из медных и цинковых пластин, между которыми были проложены кружочки ткани, пропитанные раствором щелочи.
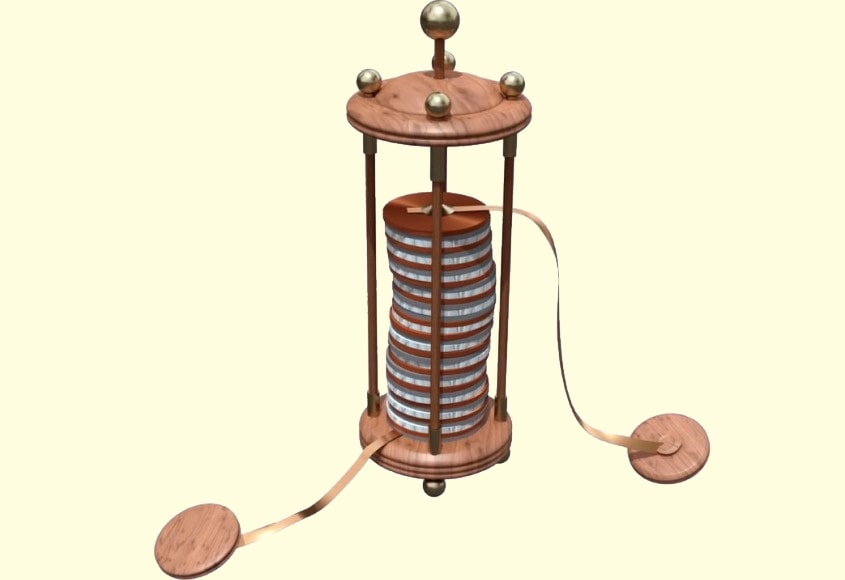
Александро Вольта предложил разделить все проводники на два рода:
- Сухие — металлы и уголь.
- Влажные — электролиты(влажные).
Шведский ученый Сванте Аррениус, изучая электропроводимость растворов различных веществ, в 1877 году пришел к выводу, что причиной электропроводимости является наличие в растворе ионов, которые образуются при растворении электролита в воде.
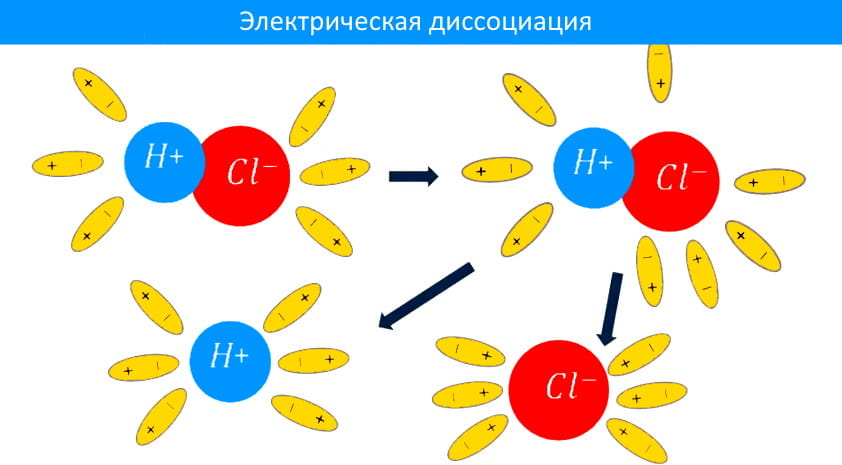
Процесс распада электролита на ионы называется электрической диссоциацией. При диссоциации в воде электролиты диссоциируют на положительно и отрицательно заряженные ионы. Под действием электрического поля, положительно заряженные ионы движутся к отрицательному полюсу источника тока (катоду) и называются катионами, а отрицательно заряженные – к положительному полюсу (аноду) и называются анионами. Таким образом электролиты обладают электронной проводимостью.
Примеры гальванических элементов:
| Название элемента | Отрицательный электрод | Положительный электрод | Электролит |
| Вольтов столб | Цинк | Медь | Раствор щелочи |
| Первый элемент Вольта | Цинк | Медь | Раствор серной кислоты |
| Элемент Даниэля | Цинк | Медь | Раствор сульфата цинка |
| Элемент Грине | Цинк | Угольный стержень | Раствор сульфата меди и бихромата калия |
| Элемент Лекланше | Цинковый цилиндр | Угольный стержень | Раствор нашатыря и оксид марганца |
| Сухой элемент | Цинковый цилиндр | Угольный стержень | Густой клейстер, приготовленный из муки на растворе нашатыря |
Эволюция батарейки — солевой гальванический элемент
Одним из первых гальванических элементов, которым можно было пользоваться вне лабораторий, была конструкция Жоржа Лекланше (1866 год). Она состояла из цинкового анода, катода из диоксида марганца с углем и электролита из хлорида аммония. Со временем элемент Лекланше эволюционировал в солевой (сухой) гальванический элемент следующим образом:
- Цинковый анод стал делаться в виде цинкового стаканчика.
- В стаканчике разместился катод из смеси диоксида марганца и графита.
- В центре катода находится угольный стержень, являющийся токосъемником (в некоторых источниках именно он неправильно называется катодом).
- Катод окружен электролитом из хлорида аммония с добавкой хлорида цинка.
- Электролит уже не в жидком виде, как у Лекланше, а в загущенном (гель). Это происходит путем добавления крахмала и муки, и необходимо для того, чтобы электролит не мог вытечь или высохнуть при хранении и эксплуатации элемента.
Конструкция сухой батареи:
 |
1 — воздушная прослойка |
| 2 — цинковый стакан | |
| 3 — электролит (NH4CL + ZnCl2) | |
| 4 — смесь графита и MnO2 | |
| 5 — угольный стержень | |
| 6 — защитный корпус |
Как работает сухая батарейка (солевой гальванический элемент)
Рассмотрим процессы, происходящие в сухом элементе. При потреблении тока электроны поступают через внешнюю электрическую цепь с цинкового электрода на угольный стержень. Происходят следующие реакции:
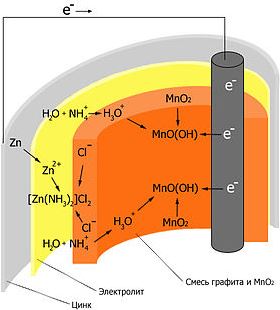 Анод: Zn → Zn 2+ + 2e−.
Анод: Zn → Zn 2+ + 2e−.- На угольном стержне электроны расходуются на восстановление H3O+ — ионов. Катод: 2H3O+ + 2e− → H2 + 2H2O.
- Ионы H3O+ образуются в результате частичного протолиза NH4+ — ионов электролита: NH4+ + H2O ↔ H3O+ + NH3.
- При восстановлении H3O+ — ионов образуется водород, который не может удалиться (корпус герметичен) и образует вокруг угольного стержня прослойку газа (поляризация угольного электрода). Ток медленно затухает. Чтобы избежать образования водорода, угольный электрод окружают слоем диоксида марганца (MnO2). В присутствии диоксида марганца H3O+ — ионы восстанавливаются с образованием воды. 2MnO2 + 2H3O+ + 2e− → 2MnO (OH) + 2H2O. Таким способом избегают поляризации электрода, а диоксид марганца называют деполяризатором. Электролит NH4Cl диссоциирует и частично протолизируется.
- В общем: 2NH4Cl + 2H2O ↔ 2NH3 + 2H3O+ + 2Cl−.
- Образующиеся на аноде ионы Zn2+ поступают в раствор и образуют труднорастворимую соль Zn2+ + 2NH3 + 2Cl− → [Zn (NH3)2]Cl2.
- Анод: Zn — 2e− → Zn2+.
- Катод: 2MnO2 + 2H3O+ + 2e− → 2MnO (OH) + 2H2O.
- Раствор электролита: Zn2+ + 2NH4+ + 2Cl− + 2H2O ↔ [Zn (NH3)2]Cl2 + 2H3O+.
- Общая реакция: Zn + 2MnO2 + 2NH4Cl → 2MnO (OH) + [Zn (NH3)2]Cl2.
Во время разрядки цинковый стакан растворяется. Во избежание вытекания электролита или продуктов реакции цинковый стакан имеет запас по толщине или окружен железной защитной оболочкой.
Что находится внутри щелочной батарейки
Впервые щелочные (алкалайновые) батарейки выпустила компания Eveready (Energizer) в 1959 году. Ее принципиальное отличие от сухой батарейки — состав электролита и конструкция. Электролит состоит не из соли аммония, как в солевой, а из раствора щелочи (обычно гидроксида калия). Конструкция элемента вывернута наизнанку по сравнению с конструкцией солевого элемента. То есть, если у солевого элемента корпус (-), а центральный токоотвод (+), то у щелочного элемента наоборот, корпус (+), а центральный токоотвод (-).
В солевых элементах при химической реакции расходуются все реагенты, составляющие этот элемент — анод, катод, электролит. А в щелочном элементе при химической реакции расходуется только анод и катод, электролит не расходуется. Поэтому электролита там совсем мало, и освободившееся место электролита заполнено увеличенным количеством анода и катода, что значительно увеличивает электроемкость щелочного элемента.
Типичная щелочная батарея выполнена в форме стального цилиндра, покрытого изолирующей пластиковой оболочкой. Положительный конец батарейки (катод) имеет выступающую наружу поверхность. Отрицательный конец (анод) — плоский. Эти две клеммы батарейки электрически изолированы друг от друга.
| 1 — никелированный стальной стакан | 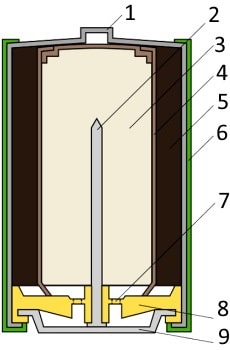 |
| 2 — латунный токосъемник | |
| 3 — анодная паста | |
| 4 — сепаратор | |
| 5 — катодная паста | |
| 6 — защитная оболочка | |
| 7 — предохранительная мембрана | |
| 8 — прокладка | |
| 9 — стальная тарелка |
Корпус батарейки обычно делается из стали с никелевым покрытием. Внутри находится несколько слоев различных материалов, химические реакции которых создают определенные уровни напряжений и токов:
- Первый слой — это катод, представляющий собой смесь оксида марганца (MnO₂) и графита. Этот материал находится в контакте с металлом положительной клеммы. Графит добавляется для улучшения проводимости смеси и увеличения плотности энергии.
- Затем идет сепаратор — слой пористого материала, который образует барьер, предотвращающий прямой контакт анодного и катодного материалов друг с другом. В процессе производства на сепаратор распыляется щелочной электролит — гидроксид калия.
- С другой стороны барьера находится анод, который представляет собой пасту, изготовленную из цинкового порошка (Zn), а также желирующего агента. Желирующий агент поддерживает цинк во взвешенном состоянии, чтобы он не накапливался в одном месте.
Как работает батарейка
Рассмотрим как работает электрическая батарейка и какие реакции взаимодействия происходят между ее химическими компонентами:
- Отрицательно заряженные ионы гидроксида (2OH-) взаимодействуют с цинком (Zn) в анодной секции. В результате химической реакции окисления получается гидроксид цинка (Zn(OH)2) и высвобождаются молекула воды и отрицательно заряженные электроны. Эти электроны теперь свободны для перемещения, и они собираются на латунном штыре (токоотводе отрицательного электрода).
- В то же время диоксида марганца (2MnO2) соединяется с молекулой воды (H2O) из электролита, а также со свободным электроном. Во время такой химической реакции восстановления диоксид марганца превращается в оксид марганца (Mn2O3). Оксид марганца больше не нуждается в атоме гидроксид-иона, поэтому он будет выбрасывать его в электролит.
- Таким образом, появляется скопление электронов на отрицательном конце батарейки. Поскольку больше отрицательно заряженных электронов на отрицательном полюсе по сравнению с положительным, образуется разность напряжений между ними, и эту разность можно измерить с помощью мультиметра.
- Электроны отталкиваются друг от друга и хотят переместиться в область с меньшим количеством электронов. Но сепаратор не позволяет им течь внутри батареи, чтобы достичь положительной клеммы. Если обеспечить электронам внешний путь (например подключив лампочку), то электроны будут течь через него и выполнять работу (заставлять лампу светится).
Пока есть полная цепь между выводами батарейки, химическая реакция будет продолжаться, и электроны будут течь от отрицательного клеммника к положительному. Если разорвать цепь, то химическая реакция прекратится.
Наглядно понять, как работает батарейка и что у нее происходит внутри, можно, ознакомившись с представленной ниже видео демонстрацией.
Как работает батарейка — видео
Химическая реакция в батарейке, к которой подключен потребитель:
- Свободные электроны поступают в батарею через положительную клемму.
- Они соединяются с оксидом марганца и молекулой воды на катоде, которая высвобождает ион гидроксида в электролит.
- Ион гидроксида проходит через сепаратор и соединяется с атомом цинка, образуя гидроксид цинка, и при этом высвобождаются электроны и молекула воды.
- Электроны хотят попасть в область с меньшим количеством электронов, так как положительная клемма имеет меньше электронов, поэтому они будут течь по проводу, чтобы достичь ее.
- Химическая реакция повторяется снова и снова до тех пор, пока не иссякнет ресурс батарейки.
Форм-фактор распространенных гальванических элементов
| Название | Напряжение, V | Диаметр, мм | Высота, мм | Стандарт (щелочные/солевые) | |
| ANSI | IEC | ||||
| Пальчиковая | 1,5 | 14,5 | 50,5 | AA | LR6/R6 |
| Мизинчиковая | 1,5 | 10,5 | 44,5 | AAA | LR03/R03 |
| Baby | 1,5 | 26,2 | 50 | C | LR14/R14 |
| Mono | 1,5 | 34,2 | 61,5 | D | LR20/R20 |
| 9 V Bloc, Крона | 9 | 26 × 22 ×67 | 1604D | 6LR61/6F22 | |
| CR2032 (монета) | 3 | 20 | 3,2 | 5004LC | CR2032 |
Подведем итог. Гальванический элемент (батарейка) — это источник электрического тока, основанный на химической реакции двух металлов (или их оксидов). Один из металлов (анод) всегда более активный, чем второй (катод). Анод и катод помещены в токопроводящую среду (электролитом). При соединении концов элемента проводником образуется электрическая цепь, начинает вырабатываться ток, который бежит от анода (-) к катоду (+). Несмотря на то, что реальные переносчики заряда (электроны) перемещаются от «минуса» к «плюсу», принято считать, что ток течет от «плюса» к «минусу» (так исторически сложилось).








